Usaha dan Proses Termodinamika
Fokus kajian kita kali ini adalah usaha dan proses termodinamika. Termodinamika mempelajari energi dan perubahan energi pada suatu sistem. Perubahan energi selalu melibatkan proses usaha didalamnya. Termodinamika hanya fokus pada usaha yang dilakukan oleh sistem terhadap lingkungan atau sebaliknya melalui proses pertukaran kalor. Sebuah konsep penting lain dalam termodinamika adalah reservoir kalor. Resevoir adalah sistem dengan kapasitas kalor sangat besar dimana sejumlah kalor dapat mengalir masuk atau keluar dari sistem tanpa adanya perubahan kalor yang signifikan.
Ada beberapa proses termodinamika yang seharusnya kita kenal. Proses-proses tersebut adalah isobar, isokhorik, isotermal, dan adibatik. Selain proses-proses tersebut ada pula proses sembarang yang terjadi pada suatu sistem. Meskipun konsep usaha dalam proses termodinamika bersifat umum, karakteristik proses menjadikan usaha pada setiap proses termodinamika berbeda. Perlu diperhatikan pula bahwa ketika menentukan usaha sistem, sistem selalu dianggap berada dalam keadaan kuasistatik. Dalam konsep ini, sistem selalu terlihat berada dalam kesetimbangan termal. Rumus usaha dalam proses sembarang dituliskan sebagai berikut ini.
Sebagai keterangan W adalah usaha (Joule), P menunjukkan tekanan (Pa), dan dV perubahan volume (meter kubik). Dalam digaram P-V tanda integaral dari persamaan usaha termodinamika menunjukkan Luas dibawah kurva. Marilah kita lihat usaha untuk masing-masing proses termodinamika.
Proses Isobar (Tekanan Tetap)
Isobar diartikan sebagai suatu proses termodinamika dimana tekanan sistem berada dalam keadaan tetap. Proses isobar dibedakan menjadi dua ada pemampatan isobarik (volume sistem mengecil dari keadaan awal) dan pemuaian isobarik (volume sistem membesar daripada volume awal). Grafik untuk pemuaian isobar dapat dilihat seperti di bawah ini.
Jika mengamati grafik di atas, luas yang berada di bawah kurva berbentuk peregi panjang dengan pangan delta V dan tinggi P. Jadi rumus usaha untuk proses isobar adalah
Proses Isobar (Tekanan Tetap)
Isobar diartikan sebagai suatu proses termodinamika dimana tekanan sistem berada dalam keadaan tetap. Proses isobar dibedakan menjadi dua ada pemampatan isobarik (volume sistem mengecil dari keadaan awal) dan pemuaian isobarik (volume sistem membesar daripada volume awal). Grafik untuk pemuaian isobar dapat dilihat seperti di bawah ini.
Jika mengamati grafik di atas, luas yang berada di bawah kurva berbentuk peregi panjang dengan pangan delta V dan tinggi P. Jadi rumus usaha untuk proses isobar adalah
V dua menunjukkan volume keadaan akhir dan V satu menunjukkan volume pada keadaan awal.
Proses Isokhorik (Volume Tetap)
Iskhorik diartikan bahwa keadaan suatu sistem mempunyai volume tetap. Jika volume tetap, perubahan volume yang terjadi pada sistem akan bernilai nol. Hasilnya adalah sistem dikatakan tidak melakukan usaha.
Proses Isokhorik (Volume Tetap)
Iskhorik diartikan bahwa keadaan suatu sistem mempunyai volume tetap. Jika volume tetap, perubahan volume yang terjadi pada sistem akan bernilai nol. Hasilnya adalah sistem dikatakan tidak melakukan usaha.
Grafik di atas menunjukkan suatu proses volume konstan, tetapi sistem mengalami kenaikan tekanan daripada kondisi awalnya. Usaha untuk isokhorik selalu bernilai nol (W=0).
Proses Isotermis (Suhu Tetap)
Iostermis diartikan bahwa suatu sistem selalu berada pada kondisi suhu tetap. Disisi yang lain, volume dan tekanan sistem berubah. Isotermis juga dibedakan menjadi dua keadaan yaitu isotermis pemamfataan dan pemuaian. Grafik untuk proses ini dalam diagram P-V adalah sebagai berikut.
Grafik diatas menunjukkan pemuaian isotermis. Perlu dipahami bahwa PV akan selalu bernilai konstan. Rumus usaha untuk proses ini adalah
R menunjukkan konstanta gas universal, n adalah jumlah mol, T suhu sistem, V dua adalah volume akhir sistem dan V satu adalah volume awal sistem.
Proses adibatik diartikan sebaga suatu proses dimana sistem tidak menyerap atau melepas kalor. Dengan kata lain kalor yang masuk atau yang keluar bernilai nol (bukan kalor sistem yang nol). Ini terjadi untuk sistem yang terisolasi atau tersekat. Diagram proses ini dalam grafik P-V dapat digambarkan sebagai berikut.
Jika dibandingkan dengan isotermis, kemiringan grafik adiabatik lebih tajam. Rumus usaha untuk proses ini adalah
Gamma adalah konstanta laplace yang menunjukkan perbandingan kapasitas panas pada tekanan tetap tehadap kapasitas panas pada volume tetap. Untuk memahami konsep dengan benar, simaklah contoh soal fisika yang terkait usaha dan proses termodinamika.
Jawab:
Besaran yang diketahui.

Sebelum menghitung usaha pada proses isobaris, tentukan terlebih dahulu volume pada keadaan kedua yaitu

Usaha pada proses isobar adalah

Latih-1: Dua meter kubik gas Helium bersuhu 77 derajat Celcius dipanaskan secara isobarik sehingga suhunya menjadi 127 derajat Celcius. Jika tekanan sistem 4 x 10 pangkat (5) Pa. Tentukanlah usaha yang dilakukan oleh gas tersebut!
Kaji-2: Satu mol gas ideal menempati suatu selinder berpenghisap tanpa gesekan, mula-mula mempunyai suhu T. Gas tersebut kemudian dipanaskan pada tekanan konstan sehingga volumenya 4 kali lebih besar. Bila R adalah tetapan gas universal, tentukanlah usaha yang dilakukan oleh gas untuk menaikan volumenya (nyatakan dalam R dan T)!
Jawab:
Besaran yang diketahui.

Hitung terlebih dahulu volume pada keadaan dua.

Usaha pada proses isobar adalah

Jawab:
Besaran yang diketahui.

Hitung terlebih dahulu volume pada keadaan dua.

Usaha pada proses isobar adalah

Latih-2: Tiga mol gas ideal menempati suatu selinder berpenghisap tanpa gesekan, mula-mula mempunyai suhu T. Gas tersebut kemudian dipanaskan pada tekanan konstan sehingga volumenya 5 kali lebih besar. Bila R adalah tetapan gas universal, tentukanlah usaha yang dilakukan oleh gas untuk menaikan volumenya (nyatakan dalam R dan T)!
Latih-3: Tiga mol gas Helium mempunyai suhu awal 27 derajat Celcius dan tekanan 1 atm. Jika suhu gas dibuat tetap seperti keadaan awal dan tekanan naik menjadi empat kali semula, tentukanlah usaha yang dilakukan oleh gas tersebut!
Kaji-4: Diagram PV di bawah ini melukiskan proses siklus yang dialami oleh gas ideal dengan keadaan awal seperti digambar. Tentukanlah usaha yang dilakukan oleh gas itu dalam satu siklus!
Jawab:
Usaha dalam satu siklus = Luas siklus (+ jika searah jarum dan (-) jika berlawanan jarum jam)
Kaji-5: Suatu sampel gas ideal mengalami ekspansi kuasistatik dari keadaan 2 meter kubik menjadi 6 menter kubik. Jika keadaan tekanan gas bersifat kuadratik dengan persamaan P= 6 Vkuadarat Pa. Tentukanlah usaha yang dilakukan oleh gas tersebut!
Jawab:
Besaran yang diketahui.
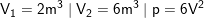
Usaha yang dilakukan oleh gas adalah

Latih-5: Suatu sampel gas ideal mengalami ekspansi kuasistatik dari keadaan 1 meter kubik menjadi 2 menter kubik. Jika keadaan tekanan gas bersifat kuadratik dengan persamaan P= 6 Vkuadarat Pa. Tentukanlah usaha yang dilakukan oleh gas tersebut!
Kaji-3: Tiga mol gas Helium mempunyai suhu awal 27 derajat Celcius dan tekanan 1 atm. Jika suhu gas dibuat tetap seperti keadaan awal dan tekanan naik menjadi empat kali semula, tentukanlah usaha yang dilakukan oleh gas tersebut!
Jawab:
Besaran yang diketahui.

Jawab:
Besaran yang diketahui.

Latih-3: Tiga mol gas Helium mempunyai suhu awal 27 derajat Celcius dan tekanan 1 atm. Jika suhu gas dibuat tetap seperti keadaan awal dan tekanan naik menjadi empat kali semula, tentukanlah usaha yang dilakukan oleh gas tersebut!
Jawab:
Usaha dalam satu siklus = Luas siklus (+ jika searah jarum dan (-) jika berlawanan jarum jam)
Jawab:
Besaran yang diketahui.
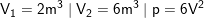
Usaha yang dilakukan oleh gas adalah

Latih-5: Suatu sampel gas ideal mengalami ekspansi kuasistatik dari keadaan 1 meter kubik menjadi 2 menter kubik. Jika keadaan tekanan gas bersifat kuadratik dengan persamaan P= 6 Vkuadarat Pa. Tentukanlah usaha yang dilakukan oleh gas tersebut!












Post a Comment for "Usaha dan Proses Termodinamika"